Situación mundial
La prevención del SRC es el principal objetivo de los programas de vacunación contra la rubéola. Antes de la introducción de la vacuna, hasta cuatro de cada 1000 nacidos vivos tenían SRC.
Una epidemia de rubéola en los Estados Unidos durante los años 1964-1965, con 12,5 millones de casos de infección por rubéola, dejó cerca de 20.000 recién nacidos con SRC.
El mayor riesgo de SRC se encuentra en países con altas tasas de susceptibilidad a la rubéola en las mujeres en edad fértil. En 1996 se estimó que 22.000 niños nacieron con SRC en África, 46.000 en el sudeste de Asia y cerca de
13.000 en el Pacífico Occidental.
La vacunación a gran escala en la última década prácticamente ha eliminado la rubéola y el SRC en los países desarrollados y en algunos países en desarrollo. En la Región de las Américas de la Organización Mundial de la Salud (OMS) no se notifican casos endémicos de rubéola desde 2009. Las máximas tasas de SRC se registran en las regiones de la OMS de África y Asia Sudoriental, en las que la cobertura con la vacuna es la más baja.
Tabla 1.
Número de casos de rubéola notificados en 2017 por región de la OMS
-
|
Región de la OMS
|
Estados declarantes
|
Casos de rubéola
|
|
AFR
|
42/47
|
4521
|
|
AMR
|
26/35
|
0
|
|
EMR
|
20/21
|
850
|
|
EUR
|
30/53
|
713
|
|
SEAR
|
11/11
|
3434
|
|
WPR
|
13/27
|
2157
|
|
Total
|
142/194
|
11.675
|
Casos de rubéola en 1999-2016:
http://apps.who.int/immunization_monitoring/globalsummary/timeseries/tsincidencerubella.html
Casos de SRC en 1999-2016:
http://apps.who.int/immunization_monitoring/globalsummary/timeseries/tsincidencecrs.html
Figura 1.
Total de caos de rubéola declarados en el mundo 1999-2016 (Fuente: Organización Mundial de la Salud)

Incidencia en Europa
En Europa, más del 90% de los países administran la vacuna de rubéola. Sin embargo, durante el año 2014, 28 países europeos reportaron 6110 casos de rubéola (Surveillance Atlas of Infectious Diseases).
En 22 de los 28 países que informaron, la tasa de notificación de la rubéola fue de menos de un caso por millón de habitantes.
Polonia representó el 96,5% de todos los casos de rubéola reportados en este periodo. Se observó el mayor número de casos en niños de 1-9 años de edad, y el 38% no estaban vacunados.
En 2017, 28 de los 30 Estados miembros de la Unión Europea/Espacio Económico Europeo notificaron 693 casos de rubéola, la mayoría de los cuales se concentraron en Polonia (496) con una incidencia de 13,06 casos por millón de habitantes, en Alemania (73) y en Italia (65).
Situación en España
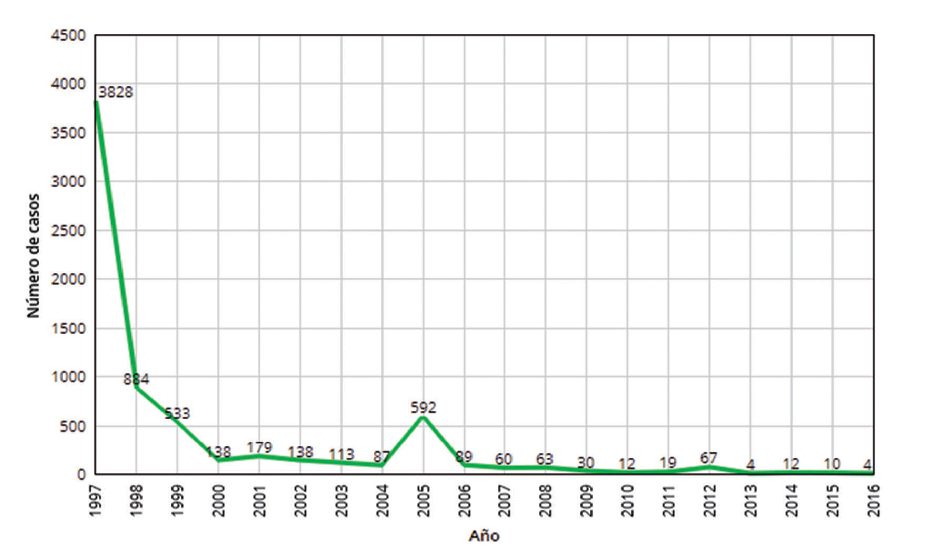
Desde la introducción de los programas de vacunación, la incidencia de la rubéola ha mostrado una disminución progresiva. Como puede observarse en la figura 2, esta disminución ha sido drástica a partir del año 1997, pasando de 3828 casos (9,73 casos por 100.000 habitantes) a menos de 884 desde 1998, con 87 casos en el año 2004 (0,21 por 100.000 habitantes) y 4 casos en el año 2013 (0,01 por 100.000 habitantes).
Las tasas de incidencia de los últimos años indican una escasa circulación viral en nuestro país, con pequeños brotes localizados en algunas comunidades autónomas, que han afectado principalmente a adultos jóvenes: población inmigrante y varones adultos no cubiertos en los programas de vacunación de nuestro país.
Según los datos de la encuesta de serovigilancia efectuada en la Comunidad de Madrid durante los años 1999-2000, la seroprevalencia en personas de 2 a 60 años fue superior al 95%. Los estudios realizados en gestantes mostraban unas cifras próximas al 99%. Sin embargo, la seroprevalencia era mucho más baja en la población inmigrante en comparación con la autóctona. En muchos países, la vacuna frente a la rubéola se ha incluido muy recientemente en los calendarios vacunales, en especial para las personas de Latinoamérica.
Ante esta situación se han producido una serie de brotes de rubéola que han mostrado unas circunstancias comunes:
- En el año 2003 se produjo un brote de rubéola en la Comunidad de Madrid que afectó principalmente a mujeres en edad fértil; el 74% (14 casos) eran mujeres de entre 15 y 38 años, procedentes de países latinoamericanos.
- En el año 2005 hubo otro brote importante en la misma comunidad autónoma, con 460 casos; el 41,6% de las afectadas eran mujeres, y de ellas un 56,2% de un país de origen diferente a España, la mayoría latinoamericanas (221 casos),
- El mismo año se notificó un brote en Cataluña que afectó a ocho personas, todas ellas de nacionalidad brasileña y sin viajes previos, pero que residían en un núcleo reducido con personas inmigrantes. Ninguna de las personas que contrajo la enfermedad estaba vacunada.
Desde la implantación de la Red Nacional de Vigilancia Epidemiológica en 1997 se han identificado 21 casos de SRC, y de ellos ocho fueron notificados al sistema de vigilancia y los demás se han recuperado por búsqueda activa en la base de datos de altas hospitalarias (conjunto mínimo de datos).
Entre los años 2003 y 2016 se notificaron 15 casos de SRC. Cabe destacar los cinco casos del año 2005: dos en la Comunidad de Madrid (hijos de mujeres de 30 y 36 años procedentes de Colombia y no vacunadas), uno en Galicia (relacionado con el brote de Madrid, hijo de una mujer de 25 años de origen colombiano que había estado en contacto con otros casos de rubéola en la Comunidad de Madrid), otro en Valencia (que podría estar relacionado con el brote de Madrid, pero que no se pudo averiguar, hijo de una mujer de 40 años de origen africano) y un último caso en Cataluña (hijo de una mujer de 30 años de origen español, no vacunada). El último caso de SRC se produjo en 2014, en el hijo de una mujer de Marruecos. En 2015 y 2016 no se notificó ningún caso.
Entre 1997 y 2016, de los 19 casos de SRC notificados en los que se conocía el país de nacimiento de la madre, solo tres habían nacido en España.
Figura 2.
Número de casos de rubéola declarados en España de 1997 a 2016
Fuente: Boletín epidemilógico semana. Instituto de Saluds Carlos




