Vacunación
Vacunas disponibles
La fiebre amarilla es una enfermedad prevenible con vacunas. Actualmente, las vacunas comercializadas contienen virus vivos atenuados de la cepa 17D, cultivados en embriones de pollo. El perfil de seguridad y efectividad de las vacunas frente a la fiebre amarilla comercializadas en todo el mundo es similar. La Agencia Europea de Medicamentos ha aprobado únicamente Stamaril® para su uso en Europa.
Indicaciones y pauta de vacunación
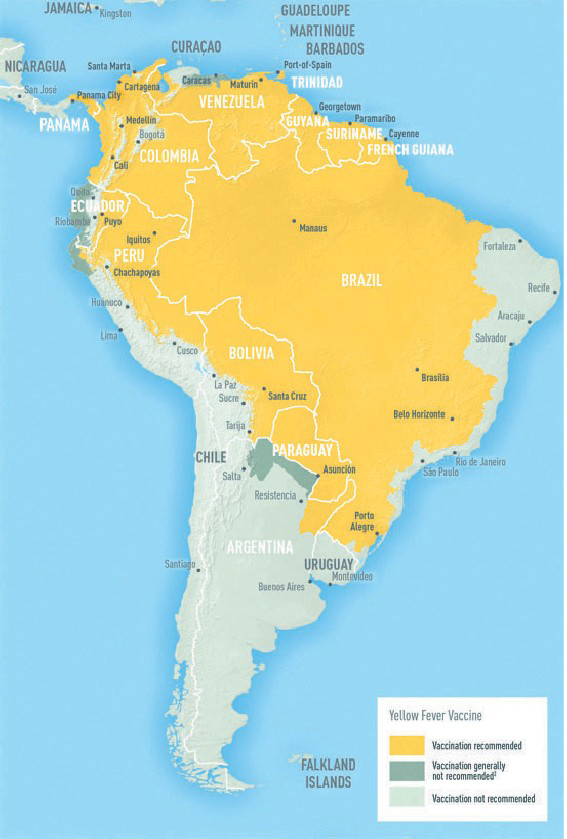
Se recomienda administrar la vacuna a sujetos de más de 9 meses de edad que viajen o vivan en zonas de riesgo de transmisión de la enfermedad (determinadas áreas de Sudamérica y África). Además, hay otros países, de estas u otras áreas geográficas, que pueden exigir un certificado de vacunación como requisito para entrar en su territorio11.
La vacuna se administra mediante una única inyección subcutánea profunda o intramuscular. Hasta hace poco se recomendaba la revacunación cada 10 años en sujetos que continuaban o volvían a estar en riesgo. Sin embargo, desde julio de 2016 no se mantiene la recomendación de revacunación. Por lo tanto, en la actualidad, una sola dosis de vacuna se considera suficiente para conferir protección de por vida11.
Coadministración con otras vacunas
La administración de vacunas inactivadas no interfiere en la seguridad ni en la inmunogenicidad de la vacuna de la fiebre amarilla. Por lo tanto, pueden administrarse simultáneamente o en cualquier momento, ya sea antes o después de la vacunación frente a la fiebre amarilla1.
Respecto a otras vacunas de virus vivos, deben administrarse simultáneamente o dejando un intervalo de 30 días entre vacunas. Esto se debe a que la respuesta inmunitaria a una vacuna de virus vivos puede verse mermada si en los 30 días siguientes se administra otra vacuna de virus vivos12.
La vacuna oral frente a la fiebre tifoidea (Vivotif®, que contiene la bacteria Salmonella typhi atenuada) puede administrarse simultáneamente o en cualquier momento antes o después de la vacunación frente a la fiebre amarilla5.
Efectividad
La vacuna frente a la fiebre a amarilla es muy efectiva, ya que protege a la práctica totalidad de los niños y adultos vacunados. Las campañas de vacunación llevadas a cabo en algunos países de África han mostrado reducir en un 27% el número de casos en el continente, y hasta un 82% en los países donde se han llevado a cabo4,10.
Certificado de vacunación internacional
Según el Reglamento Sanitario Internacional (RSI), las autoridades de cualquier país pueden exigir el certificado de vacunación internacional cuando el viajero procede de un país endémico, aunque solo haya estado en él en tránsito. A los viajeros que se dirijan a un país endémico también se les puede exigir el certificado de vacunación internacional en el que conste que la vacuna ha sido administrada previamente. Como se explica en el siguiente apartado, otros países también pueden exigir el certificado si las autoridades lo consideran oportuno13.
El certificado de vacunación internacional solo puede ser expedido por un profesional autorizado en los Centros de Vacunación Internacional que el Ministerio de Sanidad, Servicios Sociales e Igualdad pone a disposición del ciudadano en todas las comunidades autónomas del país6.
En caso de contraindicación específica para la vacunación (p. ej., alergia a un componente de la vacuna), el viajero puede ser provisto de un certificado médico de exención de vacunación antes de emprender el viaje. Es potestad del país receptor que el certificado sirva para permitir la entrada en su territorio. En cualquier caso, el viajero debe ser informado de los riesgos asociados a la falta de vacunación, así como de las formas de minimizar estos riesgos evitando las picaduras de mosquitos.
Algunos países no requieren el certificado de vacunación internacional para niños menores de cierta edad (<6 meses, <9 meses o <1 año, según el país). Es conveniente consultar dicha limitación de edad en el Centro de Vacunación Internacional o en la embajada o consulado del país a donde se pretende viajar11.